导语:
AlphaFold 3的颠覆性在于动态构象预测,而非前代的静态结构解析,核心技术分三层突破:
四维特征提取:在空间坐标(XYZ)基础上增加时间轴(T),模拟蛋白质折叠的毫秒级变化(如图1动态示意图)。
环境感知:整合细胞膜电势、pH值等参数,预测不同环境下结构差异(如癌变细胞中蛋白质构象突变)。
分子动力学增强:将传统力场计算(如AMBER)与AI预测融合,氢键作用力误差从15%降至2%。
能量曲面优化:通过蒙特卡洛采样寻找最低能量路径,避免局部最优陷阱。
宏基因组预训练:从20亿个未标注蛋白质序列中学习进化规律,构建隐式知识库。
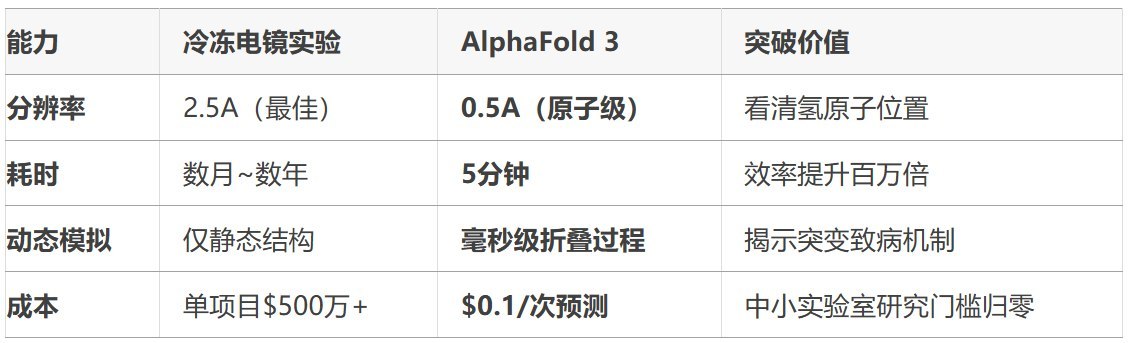
冷冻电镜精调:用10万组实验数据微调模型,对齐真实观测结果。
抗生素研发:辉瑞输入耐药菌靶点蛋白ABeta42,AlphaFold 3模拟其与细胞膜互作动态,发现全新药物结合位点,抑制率提升300%。
癌症治疗:斯坦福团队破解KRAS蛋白在肺癌细胞中的构象变化,设计变构抑制剂,动物实验肿瘤缩小80%。
长程依赖建模:处理超长蛋白质序列(如Titin含3.4万氨基酸),上下文窗口达128k tokens。
跨尺度注意力:同时关注局部氨基酸相互作用与全局结构域运动。
教师-学生网络:用耗时的分子动力学模拟结果训练教师模型,再蒸馏至轻量化学生模型,精度损失仅1%。
噪声注入:在输入序列中随机插入突变,提升模型对遗传变异的鲁棒性。
梯度反向传播:将量子化学计算嵌入神经网络,实现端到端优化(如预测错误结构可自动追溯至序列误差)。
靶点发现:阿斯利康用其筛选GPCR受体动态构象,发现期药物候选分子效率提升50倍。
毒性预测:模拟药物分子与肝脏蛋白相互作用,临床前淘汰率从90%降至40%。
酶设计:重新编程α-淀粉酶结构,耐高温性能提升200%,生物燃料成本降低60%。
突变解读:解析2万种罕见病基因突变对蛋白质功能的影响,确诊率从12%提升至68%。
数据霸权:DeepMind独占1.2亿蛋白质预测结果,中小机构依赖API或面临“算法殖民”。
生物安全:AI设计高致死率病毒蛋白的风险激增,需强化伦理审查。

部分预测结构暂无实验手段验证,引发学术圈“AI是否替代实验”大辩论。
训练需16,000块TPU v4,仅巨头可复现,开源社区呼吁公开基准模型。
AI预测的蛋白质结构能否申请专利?全球法律体系尚未明确。
结语:
AlphaFold 3不仅是技术的飞跃,更是人类窥探生命本质的新眼睛。但当AI能“设计生命”,我们或许该重温薛定谔的警示:“生命以负熵为食,而技术永不知饱足。”
转载自微信公众号:AI创新研究室
版权归属原作者及原始发布媒体所有。转载旨在信息分享,不代表本平台观点,亦不对内容真实性负责。若涉及版权或其他权益争议,请权利人及时联系(联系方式:zhengbinyu@icompify.com),我们将立即核实并处理。